毛宗万/夏炜教授团队Angew. Chem. Int. Ed.:双锁结构的铂(IV)前药助力化学免疫治疗
铂类化疗药物已被广泛应用于癌症治疗,并且对患者具有一定的治疗效果,大大提高了癌症患者的生存率。然而,这些Pt(II)复合物中只有一小部分能够到达细胞核结合DNA,而大多数药物与其他细胞生物分子结合。这些“脱靶”Pt(II)复合物通常会引起全身毒性和其他副作用以及有限的抗肿瘤机制限制了临床使用,成为解决铂类药物的难题。
Toll-like受体(TLR)激动剂是先天性免疫的有效激活剂,在癌症免疫治疗中具有重要的应用前景值得注意的是,包括雷昔莫特(R848)在内的TLR7/8激动剂显示出激活多种抗原呈递细胞(APCs)群体的能力,从而促进免疫抑制肿瘤微环境从M2样表型向M1样表型的极化,并诱导促炎细胞因子和趋化因子的分泌。然而,TLR7/8激动剂作为免疫治疗剂的应用一直受到剂量限制性毒性和引发全身炎症等问题。线上赌博app-赌博软件下载
毛宗万/夏炜团队利用在一系列恶性肿瘤中过表达的γ-谷氨酰转肽酶(GGT),可以选择性地切割细胞外谷胱甘肽(GSH)的γ-谷氨酰键,设计了一种新的双锁Pt(IV)前药,前药可以通过谷胱甘肽和γ-谷氨酰转肽酶(GGT)的顺序激活,从而在肿瘤微环境中靶向释放细胞毒性Pt(II)和TLR7/8激动剂IMDQ,显著提高了化疗和免疫治疗之间的协同作用根除了原发肿瘤,并建立了持久的保护性免疫来抑制肿瘤复发,为靶向癌症治疗提供一种变革性的方法。

图(1)Pt-Glu-IMDQ前药介导化学-免疫协同治疗消除肿瘤
本研究先聚焦双锁Pt(IV)前药结构如何通过空间限制药物激活,通过谷胱甘肽和γ-谷氨酰转肽酶(GGT)的顺序激活,从而在肿瘤微环境中靶向释放细胞毒性Pt(II)和TLR7/8激动剂IMDQ,引发了凋亡和铁死亡的双重细胞毒性作用。
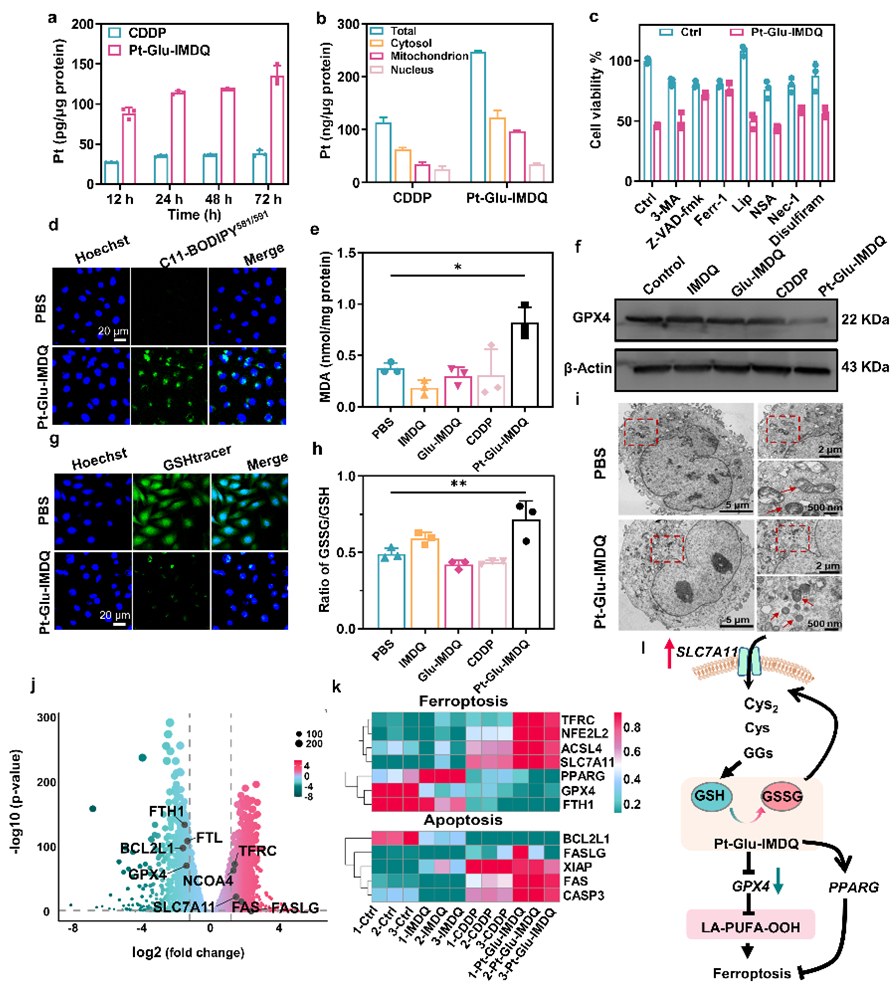
图(2)Pt-Glu-IMDQ前药在细胞上的摄取分布及引发凋亡和铁死亡双重死亡方式
随后,Pt-Glu-IMDQ通过巨噬细胞复极化和树突状细胞成熟增强先天免疫,同时通过效应T细胞浸润和记忆T细胞生成增强适应性反应。利用化疗和免疫治疗之间的协同根除了原发肿瘤,建立的持久保护性免疫来抑制肿瘤复发,取得了良好的治疗效果,且未对小鼠健康产生明显影响,安全性良好。该研究设计的双锁铂(IV)前药介导化疗与免疫治疗手段联合使用,有望提升其疗效,成为精准癌症治疗的重要工具。
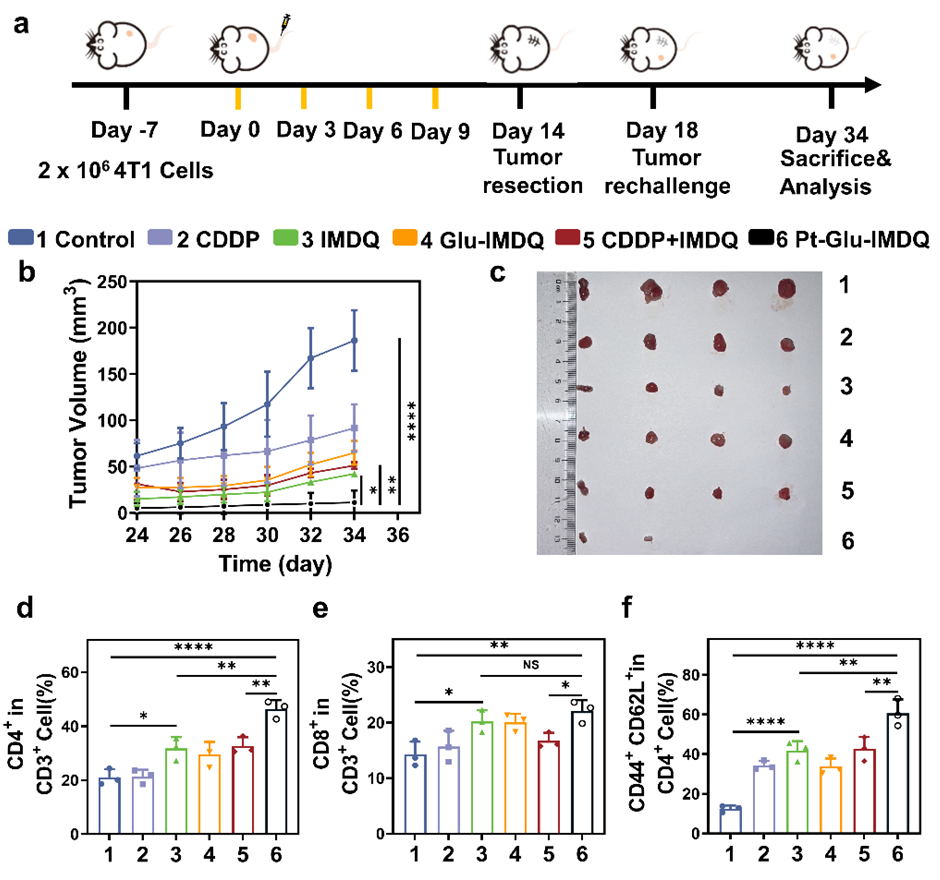
图(3)Pt-Glu-IMDQ前药在4T1肿瘤小鼠模型中的抗肿瘤效果
这一研究成果最近发表在Angewandte Chemie International Edition上。线上赌博app-赌博软件下载
博士生孟禾、王锦辉为论文共同第一作者,毛宗万教授、夏炜教授为共同通讯作者。该项目获得国家自然科学基金,科技部重点研发项目,广东省自然科学基金等项目的资助。
论文信息:He Meng#, Jinhui Wang#, Hongyu Wen, Zilong Xu, Liuruiqi Luo, Wenkai Lin, Kai Lu, Yuxiang Lu, Jing Wang, Yufang Xiong, Jianqiao Xu, Zong-Wan Mao*, Wei Xia*, Evoking Simultaneous Ferroptosis and Apoptosis by a Dual-Locked Platinum (IV) Prodrug for Synergistic Chemo-immunotherapy. Angew. Chem. Int. Ed. 2025, e202505930.
全文链接://onlinelibrary.wiley.com/doi/10.1002/anie.202505930

