中山大学巢晖教授团队Angew. Chem. Int. Ed.:线粒体靶向铱(III)基免疫原性胀亡诱导剂增强癌症化学免疫治疗
多数临床化疗药物(如顺铂、紫杉醇、阿霉素等)通过诱导肿瘤细胞凋亡发挥作用,但常受低疗效和多药耐药(MDR)困扰。MDR机制包括癌细胞增强药物外排、凋亡通路抑制或DNA 损伤修复能力增强等,是癌症治疗的重要临床障碍。胀亡(Oncosis)是一种不依赖于三磷酸腺苷(ATP)和凋亡通路的炎症性细胞死亡形式,具有克服肿瘤耐药性和调节抗肿瘤免疫反应的独特优势。其由 porimin 蛋白介导,特征为线粒体肿胀、质膜破裂及后续炎症反应,能快速导致 ATP 耗竭,抑制 ABC 转运体活性和药物外排,且不依赖胱天蛋白酶,可规避凋亡相关耐药机制。
近日,中山大学巢晖教授团队设计开发了一类线粒体靶向的铱(III)基免疫原性胀亡诱导剂。该类诱导剂不仅能有效突破肿瘤多药耐药瓶颈,还可通过激活机体免疫系统,实现化疗与免疫治疗的协同增效,为癌症治疗提供了新策略(图 1)。研究表明,这类铱(III)基配合物具备多重优势:其一,可通过原位可视化实现细胞内定位追踪,同时显著克服顺铂、阿霉素等临床常用化疗药物的耐药性局限;其二,能高效诱导免疫原性细胞死亡(ICD),并协同激活 cGAS-STING 通路,成功构建 “化疗杀伤–免疫激活” 的协同治疗模式。从作用机制来看,配合物能快速靶向肿瘤细胞线粒体,破坏其结构完整性,同时升高细胞内氧化应激水平、促进钙离子(Ca2+)释放。这一系列变化会进一步激活Calpain和Porimin蛋白,最终在多药耐药肺癌细胞(A549R)中启动胀亡通路。此外,转录组学分析证实,其还能通过重组肌动蛋白细胞骨架、调节 ABC 转运蛋白活性、重塑糖酵解与糖异生代谢途径。
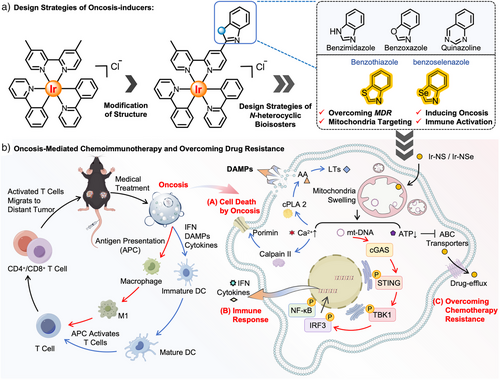
图1. 线粒体靶向铱(III)基免疫原性胀亡诱导剂的化学免疫治疗作用机制图。
本研究采用生物电子等排体设计策略,对铱(III)多吡啶配合物进行简单杂环修饰,开发结构简单、合成高效、线粒体靶向的铱(III)基胀亡诱导剂,并成功筛选出苯并噻唑和苯并硒唑是诱导胀亡的关键结构(图2)。这类铱(III)配合物引发胞内Ca2+超载,特异性激活钙依赖性蛋白酶(Calpain),同时上调膜蛋白 Porimin 的表达,最终共同驱动细胞进入胀亡程序。
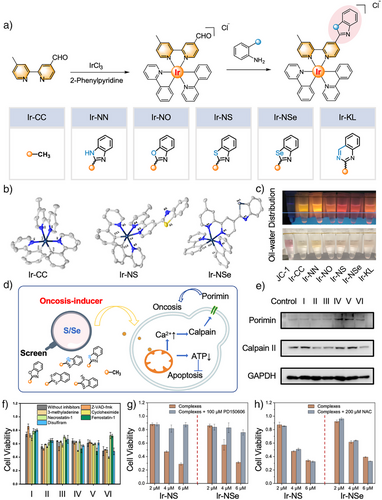
图2. 铱(III)基胀亡诱导剂的设计及筛选。
借助激光共聚焦成像与超分辨荧光成像技术可直观观测到:铱(III)基胀亡诱导剂富集于癌细胞线粒体后,会迅速造成线粒体结构崩解(如肿胀、嵴损伤)。在胀亡过程中,纤维状F-actin解聚导致细胞骨架网络解体、细胞结构不可逆坍塌(图3)。
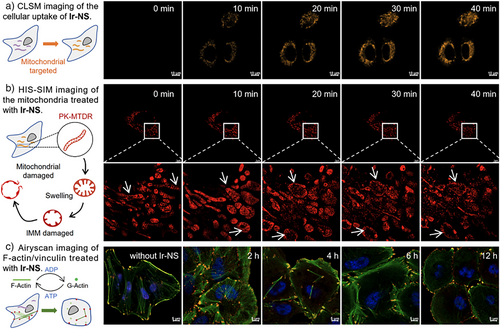
图3. a)铱基胀亡诱导剂的示踪; b)线粒体结构变化; c)细胞骨架变化。
铱基胀亡诱导剂导致线粒体功能障碍和mt-DNA损伤可强效激活 cGAS-STING 先天免疫通路和细胞免疫原性死亡,双重作用共同激活免疫反应,包括树突状细胞成熟、M1 型巨噬细胞极化以及细胞毒性 T 细胞激活,从而重塑肿瘤免疫微环境,并在体内建立长期免疫记忆。凭借化疗与免疫治疗的协同效应,该体系不仅有效根除原发肿瘤,还能建立持久保护性免疫屏障以阻断肿瘤复发,治疗成效显著(图4)。同时未对小鼠产生明显健康损害,安全性得到充分验证。
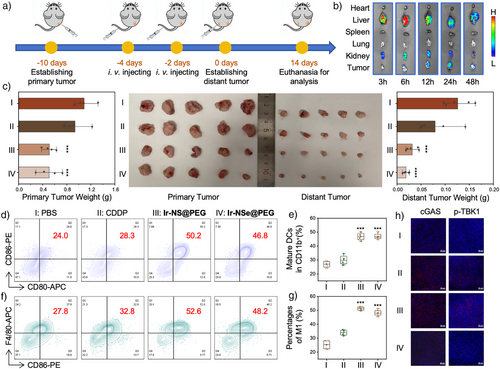
图4. 铱基胀亡诱导剂在肿瘤小鼠模型中的治疗效果。
这一成果近期发表在Angewandte Chemie International Edition上,中山大学舒军博士为论文第一作者,中山大学巢晖教授为论文通讯作者,四川轻化工大学蒋维东教授、德国波鸿鲁尔大学 Johannes Karges 教授、法国巴黎文理研究大学 Gilles Gasser 教授作为共同通讯作者。上述该研究得到了国家自然科学基金(22120102002、92353301)、湖南省科技创新计划(2021RC5028)等项目大力支持。
论文信息:Jun Shu, Xianbo Wu, Zixin Tang, Tao Feng, Johannes Karges, Weidong Jiang, Gilles Gasser, Hui Chao, Boosting Cancer Chemoimmunotherapy with Mitochondria-Targeting Iridium(III)‐Based Immunogenic Oncosis Inducers. Angew. Chem. Int. Ed. 2025, e21242.
全文链接://onlinelibrary.wiley.com/doi/10.1002/anie.202521242

